2024年3月29日下午,中国血脂管理指南修订联合专家委员会通过线上+线下的方式在北京国宾酒店召开中国血脂管理指南(基层版2024年)解读会。本次会议由国家心血管病中心专家委员会、中华医学会心血管病学分会、中华医学会糖尿病学分会、中华医学会内分泌学分会、中华医学会检验学分会、中国卒中学会和北京高血压防治协会主办。
近几十年来,中国人群的血脂异常患病率不断升高,血脂管理刻不容缓,在基层开展血脂规范管理尤为重要。为便于基层医师更好地开展血脂管理,中国血脂管理指南修订联合专家委员会在2023年中国血脂管理指南的基础上制定了2024年中国血脂管理指南(基层版)。

本次解读会期间来自首都医科大学附属北京同仁医院的史旭波教授进行了《从动脉粥样硬化发病机制看未来调制治疗方向》的精彩分享,史教授从动脉粥样硬化发病机制入手,潜移默化地谈到目前ASCVD防治所面临的困境以及未来可能突破困境所需要的方向,或许30年前的老药普罗布考是破局ASCVD进展的关键。
01 ASCVD防治的现状
近年来,动脉粥样硬化防治工作取得了显著的成就,这些成就主要体现在急性血栓事件后的救治成功率的大幅提升。然而,对于动脉粥样硬化本身的治疗仍处于较为基础的阶段。值得注意的是,动脉粥样硬化导致的血栓疾病至今仍占据全球死亡原因的首位,这背后的原因是多方面的,既包括对危险因素防控不力,也有对斑块自身发展过程认知不足的深层次原因。此外,对斑块进展关键点的控制手段也非常有限。近期的一些热门药物如普罗布考,或许能够成为突破当前动脉粥样硬化防治瓶颈的关键。
02 回顾ASCVD斑块形成机制
目前的研究认为,在正常生理状态下,人体细胞膜需要胆固醇来维持其功能,因此,血液中的脂蛋白颗粒必须能够扩散到全身的各个组织液中,以满足这种生理需求。在血管壁中,这些脂蛋白颗粒可以正常代谢掉胆固醇。在大多数情况下,进入血管壁的脂蛋白颗粒数量与身体的生理需求是相匹配的。但是在特定情况下,比如当脂蛋白颗粒浓度过高时,会导致大量的超额脂蛋白颗粒进入血管壁,超出了生理需求,导致这些脂蛋白颗粒在血管壁中积累。这种在血管壁中的过量脂蛋白颗粒积累,会触发机体的自然纠错机制,即炎症反应,尤其是单核-巨噬细胞参与的炎症反应。这种炎症反应的本质是为了纠正血管壁中过多的脂蛋白颗粒积累这一异常情况。然而,这种纠错过程中可能会出现失衡,导致动脉粥样硬化斑块的形成。
控制/清理斑块的3个关键步骤
首先,主要的清理力量是单核巨噬细胞,但这些细胞通常只会清理异物,不会清理正常的生理物质。为了使机体能够识别并清理血管壁中局部积累的正常脂蛋白颗粒,这些颗粒需要经历一个关键的步骤——氧化修饰。氧化修饰过程复杂,本质上是一种防御机制,可能会过度发动,导致不良反应。因此,抗氧化治疗可能成为有价值的靶点。
氧化修饰完成后,下一个重要步骤是让机体能够识别脂蛋白颗粒,将它们作为异物进行清理。而单核巨噬细胞如何进入具体位置进行清理,则涉及到炎症反应。血管壁哪个部位有炎症反应,单核巨噬细胞在趋化因子指引下直接进入血管壁,单核巨噬细胞通过清道夫受体快速识别并吞噬已标记的氧化脂蛋白颗粒,形成泡沫细胞,这是动脉粥硬化过程中的关键。
泡沫细胞形成是正常的生理现象,但吞噬过量胆固醇时,单核巨噬细胞无法处理,这个时候胆固醇逆转运机制尤为重要,它通过高密度脂蛋白(HDL)将胆固醇运至肝脏再排出。HDL被认为是“好”胆固醇,可以与泡沫细胞接触,将无法利用的胆固醇转移至HDL颗粒中,随后HDL颗粒将其运送到肝脏。在肝脏,这部分胆固醇或被再利用,或通过胆汁排出体外,形成一个完整的闭环。
因此整体来看,对于动脉粥样硬化初期,因为脂蛋白颗粒浓度升高,导致内皮受损,脂蛋白颗粒沉积血管壁,经氧化修饰后被巨噬细胞通过清道夫受体吞噬成泡沫细胞。不能消化的部分泡沫细胞裂解,其余被HDL颗粒处理后返回循环,完成清理过程。正常情况下,是不会形成动粥斑块的。实际情况如何呢?
真实世界里——事与愿违
第一个问题:单核巨噬细胞在局部有数量限制,后期炎症扩大招募更多细胞清理,但脂蛋白颗粒氧化修饰沉积过多,导致细胞数量与清理需求不匹配。局部脂蛋白颗粒堆积是长期过程,炎症不断放大招募更多细胞,同时使已在血管局部的细胞包括泡沫细胞滞留更久。由于清道夫受体无节制吞噬颗粒,长时间滞留会促进细胞死亡。而单核巨噬细胞死亡,特别是泡沫细胞,涉及复杂过程。泡沫细胞内充满脂质颗粒,死亡后释放出游离脂质,这对机体是一个挑战。正常情况下,HDL颗粒可缓慢清除这些脂质,但在泡沫细胞大量死亡时,机体难以及时处理,导致局限化反应,平滑肌细胞分泌纤维组织包裹残骸,形成粥样斑块。脂蛋白颗粒过量积累是粥样斑块形成的关键因素,超出了机体的清理能力,从而促成了不良结局,形成斑块。
第二,氧化修饰在整个过程中会起个不佳的作用,大量的氧化修饰会把堆积的和正常渗透的一股脑的全部放大,这种修饰会形成更加过量的氧化脂蛋白颗粒,那么也加剧不良结局——斑块。
第三,逆转移能力不足,若用超量HDL颗粒帮助泡沫细胞转移吞噬颗粒,可减少其死亡。但这也取决于个体能力。HDL高是好的,但可能阻止不了大量泡沫细胞的产生。
所以动脉粥样硬化形成涉及的三个关键因素:脂蛋白颗粒堆积,氧化修饰过度和逆转移能力不足。这些因素会导致动脉粥样硬化斑块的形成。目前治疗策略需要针对这些环节。
03 目前动脉粥样硬化的治疗现状
经过多年探索,最成功且关键的方法是减少循环中脂蛋白颗粒的浓度,避免其堆积和后续复杂反应,从而减少不良结果。这一手段已被反复证明是最有效的。为了降低脂蛋白颗粒,已研发出多种治疗手段,如他汀类、依折麦布、普罗布考、PCSK9单克隆抗体和小分子英克西兰等,均旨在减少血管内脂蛋白颗粒的堆积。然而,这仅解决了部分问题,因为脂蛋白颗粒的堆积是由脂蛋白颗粒浓度高和内皮损伤等多个因素共同作用的结果。
除降低脂蛋白颗粒浓度外,还可以对抗氧化治疗给予关注。近年研究进展发现,普罗布考(FDA批准的抗氧化剂)能有效对抗氧化过程,其特点是直接补充电子,阻止氧化链式反应,且能自我修复。特别是普罗布考逆转黄色瘤,这是其显著特点,尽管其降胆固醇效果相对较弱,但其他强效胆固醇药物对此无效。普罗布考的强大作用归因于其独特的抗氧化机制。
第三个是提升HDL性能,减少坏胆固醇堆积,帮助逆转运。他汀类药物出现后,大家转向寻找能升高HDL的药物。但经历了惨痛失败,直到发现CETP抑制剂,能大幅提升HDL性能。简单的理解是,人类利用旁路机制解决胆固醇问题,其中CETP蛋白将HDL中的胆固醇转化为VLDL或LDL,同时交换甘油三酯。HDL随后裂解甘油三酯,释放空间继续转运胆固醇,这些颗粒最终回到肝脏。CETP抑制剂能显著提高HDL-C水平,但在临床试验中全部失败,因为仅提高装满甘油三酯和胆固醇的HDL无效。所以过去被忽视的普罗布考药物,因降低HDL-C随着他汀类药物的出现而不再受关注。但普罗布考作为CETP激活剂,能帮助HDL卸载胆固醇,虽降低HDL-C但提高逆转运效能的作用是有益的。
所以,普罗布考通过提升HDL颗粒能力,减少泡沫细胞死亡和局部堆积,褪退黄色瘤,为动脉粥样硬化防治提供新思路。该药能降胆固醇,抗氧化,有助于突破当前防治瓶颈。尽管是老药,但其新机制为疾病治疗带来希望。
指南推荐:普罗布考
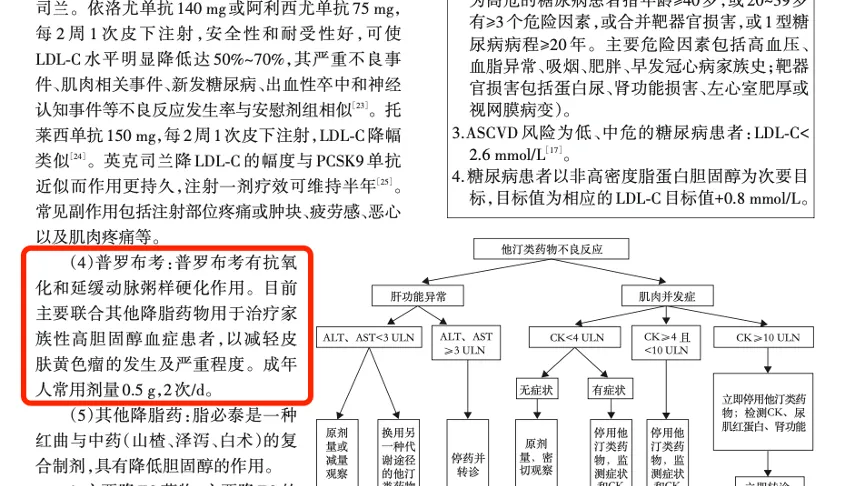
中国血脂管理指南(基层版2024年)中明确提到,普罗布考有抗氧化和延缓动脉粥样硬化作用,引起广大医生的关注。